Apa Itu Kimia?
Kimia adalah ilmu yang mempelajari komposisi, sifat, struktur, transformasi, dan reaksi materi. Ilmu kimia melibatkan pemahaman tentang unsur-unsur kimia, senyawa, dan perubahan yang terjadi saat mereka berinteraksi. Disiplin ini berperan penting dalam berbagai aspek kehidupan kita, seperti obat-obatan, makanan, energi, kosmetik, dan lingkungan.
Senyawa dan Unsur Kimia
Senyawa kimia terdiri dari dua atau lebih unsur kimia yang terikat secara kimiawi. Contohnya adalah air (H2O), yang terdiri dari dua atom hidrogen (H) dan satu atom oksigen (O). Unsur kimia, di sisi lain, adalah zat murni yang tidak dapat diuraikan menjadi substansi yang lebih sederhana melalui reaksi kimia. Contoh unsur kimia adalah hidrogen (H), oksigen (O), dan karbon (C).
Apa Itu Stoikiometri?
Stoikiometri adalah bagian dari kimia yang berfokus pada perhitungan hubungan kuantitatif antara reaktan dan produk dalam sebuah reaksi kimia. Stoikiometri memungkinkan kita untuk menentukan jumlah relatif dari berbagai unsur dan senyawa yang terlibat dalam reaksi, serta memahami hubungan massa dan jumlah partikel yang terlibat dalam reaksi tersebut.
Perhitungan dalam Stoikiometri
Rumus dan persamaan kimia digunakan dalam perhitungan stoikiometri. Rumus kimia menggambarkan komposisi molekul dan memungkinkan kita untuk menghitung jumlah partikel yang terlibat dalam reaksi. Persamaan kimia, di sisi lain, menggambarkan reagen dan produk yang terlibat dalam reaksi, serta perbandingan stoikiometri antara mereka.
Jika Diketahui Perbandingan Massa Magnesium dan Oksigen dalam Suatu Senyawa
Dalam kimia, kita sering kali perlu menghitung jumlah massa dari berbagai bahan kimia yang terlibat dalam suatu reaksi. Misalnya, jika kita diketahui perbandingan massa magnesium (Mg) dan oksigen (O) dalam suatu senyawa, kita dapat menggunakan perhitungan stoikiometri untuk menentukan jumlah relatif dari kedua elemen tersebut.

Misalnya, dalam suatu senyawa, perbandingan massa magnesium dan oksigen adalah 3:2. Jika kita memiliki 6 gram magnesium, berapa gram oksigen yang terlibat dalam senyawa tersebut?
Langkah 1: Tentukan Persamaan Kimia
Langkah pertama dalam perhitungan stoikiometri adalah menentukan persamaan kimia yang sesuai dengan reaksi yang terjadi. Dalam hal ini, kita tidak diberikan persamaan kimia spesifik, tetapi kita tahu bahwa senyawa tersebut mengandung magnesium dan oksigen. Sebagai contoh, kita bisa gunakan persamaan berikut:
2Mg + O2 → 2MgO
Langkah 2: Hitung Jumlah Mol
Setelah kita memiliki persamaan kimia, langkah berikutnya adalah menghitung jumlah mol dari zat yang diketahui. Dalam kasus ini, kita memiliki 6 gram magnesium. Untuk menghitung jumlah mol, kita perlu menggunakan massa molar magnesium.
Massa molar magnesium (Mg) = 24,31 g/mol (ambil dari tabel periodik)
Jumlah mol magnesium = massa magnesium / massa molar magnesium
Jumlah mol magnesium = 6 g / 24,31 g/mol
Jumlah mol magnesium = 0,247 mol
Langkah 3: Gunakan Perbandingan Stoikiometri
Setelah kita mengetahui jumlah mol magnesium, kita dapat menggunakan perbandingan stoikiometri dalam persamaan kimia untuk menentukan jumlah mol oksigen yang terlibat.
Berdasarkan persamaan kimia yang kita gunakan sebelumnya:
2Mg + O2 → 2MgO
Perbandingan stoikiometri antara magnesium dan oksigen adalah 2:1. Artinya, untuk setiap 2 mol magnesium yang bereaksi, akan ada 1 mol oksigen yang bereaksi.
Jumlah mol oksigen = 0,247 mol magnesium × (1 mol oksigen / 2 mol magnesium)
Jumlah mol oksigen = 0,1235 mol
Langkah 4: Hitung Jumlah Massa
Sekarang kita telah mengetahui jumlah mol oksigen yang terlibat dalam reaksi. Untuk menghitung jumlah massa oksigen yang terlibat, kita perlu menggunakan massa molar oksigen.
Massa molar oksigen (O) = 16,00 g/mol (ambil dari tabel periodik)
Jumlah massa oksigen = jumlah mol oksigen × massa molar oksigen
Jumlah massa oksigen = 0,1235 mol × 16,00 g/mol
Jumlah massa oksigen = 1,976 g
Tabel Periodik Unsur Kimia
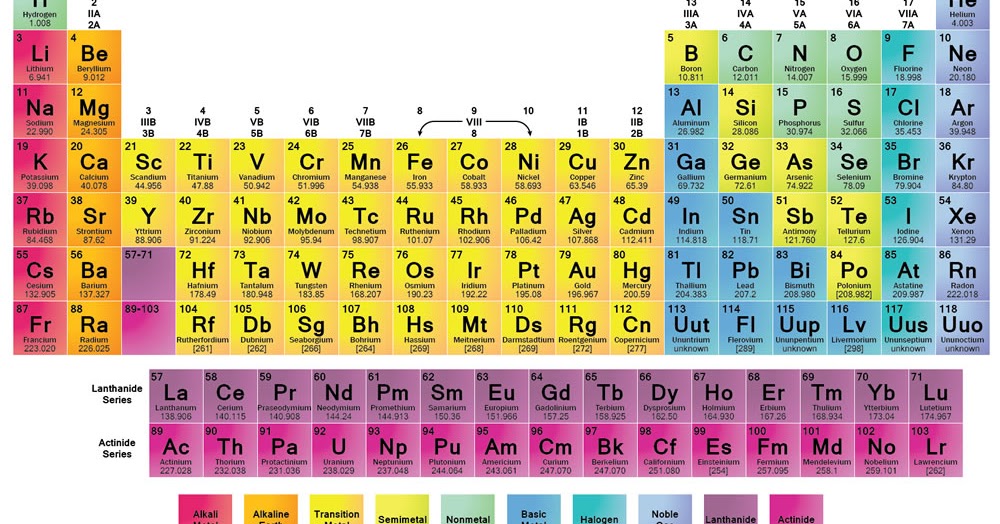
Tabel periodik unsur kimia adalah gambaran sistematis unsur-unsur kimia yang tersusun dalam urutan yang meningkat berdasarkan nomor atom mereka. Dalam tabel periodik, setiap unsur ditempatkan di kotaknya masing-masing berdasarkan sifat dan karakteristiknya.
Tabel periodik menyajikan informasi seperti simbol unsur, nama unsur, nomor atom, massa atom relatif, dan konfigurasi elektron dari unsur tersebut. Hal ini memudahkan kita untuk mempelajari dan memahami sifat-sifat unsur kimia serta memahami pola-pola yang ada dalam tabel periodik.
Tabel periodik juga digunakan dalam berbagai aspek kimia, seperti menentukan sifat dan reaktivitas unsur-unsur, mengidentifikasi elemen dalam senyawa, dan mendapatkan informasi penting tentang sifat fisik dan kimia unsur-unsur.




