Metode pengelompokan unsur dengan hukum Oktaf merupakan salah satu cara yang digunakan untuk mengklasifikasikan unsur-unsur kimia berdasarkan sifat-sifat periodiknya. Pengelompokan ini didasarkan pada pengamatan bahwa setiap elemen memiliki sifat yang serupa dengan elemen yang berada di sebelahnya pada setiap periode tertentu.
Soal Salah satu kelemahan metode pengelompokan unsur dengan hukum Oktaf
Metode pengelompokan unsur dengan hukum Oktaf tidak sepenuhnya sempurna dan memiliki beberapa kelemahan. Salah satu kelemahan utamanya adalah bahwa hukum Oktaf hanya berlaku untuk unsur-unsur yang memiliki massa atom yang rendah dan terbatas pada beberapa periode pertama tabel periodik. Hukum ini tidak berlaku untuk unsur-unsur yang memiliki massa atom yang lebih tinggi.
Kelemahan lain dari metode ini adalah bahwa hukum Oktaf mengabaikan beberapa perbedaan dalam sifat-sifat unsur. Misalnya, dalam hukum Oktaf, unsur karbon ditempatkan bersama dengan unsur nitrogen dan oksigen karena memiliki sifat-sifat yang serupa. Namun, sifat-sifat kimia karbon sangat berbeda dari sifat-sifat kimia nitrogen dan oksigen. Hal ini mengindikasikan bahwa hukum Oktaf tidak dapat menjelaskan perbedaan sifat-sifat ini.
Kelemahan lain metode pengelompokan unsur dengan hukum Oktaf adalah bahwa hukum ini tidak dapat menjelaskan penempatan unsur-unsur transisi dalam tabel periodik. Unsur-unsur transisi biasanya memiliki sifat-sifat yang berbeda dari unsur-unsur lainnya, tetapi hukum Oktaf tidak dapat menjelaskan kelompok mana di mana unsur-unsur transisi ini seharusnya ditempatkan.
Foto : Hukum Oktaf Newlands Halaman 2
John Alexander Newlands adalah seorang kimiawan Inggris yang menjadi tokoh penting dalam pengembangan hukum Oktaf. Ia mengusulkan hukum Oktaf pada tahun 1865, yang didasarkan pada pengamatan bahwa setiap elemen di dalam tabel periodik memiliki sifat-sifat yang berulang setiap delapan elemen.
Hukum Oktaf memainkan peran penting dalam pengembangan ilmu kimia dan membantu mengorganisasikan unsur-unsur menjadi suatu sistem yang teratur. Meskipun memiliki beberapa kelemahan, hukum Oktaf tetap menjadi tonggak sejarah dalam pengklasifikasian unsur-unsur kimia.
Foto : Hukum Oktaf Newlands

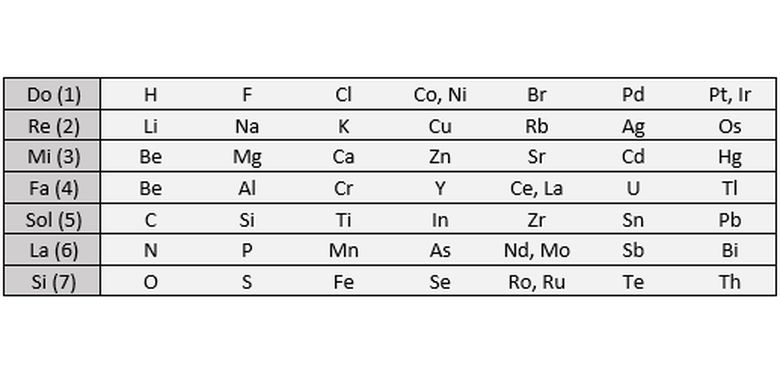
Hukum Oktaf Newlands menyatakan bahwa setiap unsur memiliki sifat yang serupa dengan unsur yang berada delapan tempat di atas atau di bawahnya dalam tabel periodik. Sifat yang berulang ini dapat diamati pada setiap periode tabel periodik. Dalam hukum Oktaf, unsur-unsur yang memiliki sifat-sifat yang serupa ditempatkan dalam satu oktaf, yang terdiri dari delapan unsur.
Hal ini dapat dilihat pada contoh berikut. Unsur lithium (Li) memiliki sifat-sifat yang serupa dengan unsur natrium (Na) dan kalium (K) yang berada delapan tempat di atasnya dalam tabel periodik. Begitu pula dengan unsur fluorin (F) yang memiliki sifat-sifat yang mirip dengan unsur klorin (Cl) dan bromin (Br) yang berada delapan tempat di atasnya.
Namun, hukum Oktaf memiliki batasan dalam pengelompokan unsur-unsur. Hukum ini hanya berlaku untuk unsur-unsur yang memiliki massa atom yang rendah dan terbatas pada beberapa periode pertama tabel periodik. Unsur-unsur dengan massa atom yang lebih tinggi tidak mengikuti pola yang sama dan tidak dapat dikelompokkan dalam oktaf.
Bagaimana hukum oktaf dalam pengelompokan unsur-unsur?
Hukum Oktaf, yang dikemukakan oleh John Alexander Newlands, mengklasifikasikan unsur-unsur dalam tabel periodik berdasarkan pengulangan sifat-sifat yang terjadi setiap delapan elemen. Dalam hukum Oktaf, unsur-unsur dengan sifat-sifat serupa dikelompokkan bersama dalam oktaf, yang terdiri dari delapan unsur.
Hukum Oktaf memainkan peran penting dalam perkembangan ilmu kimia dan membantu para ilmuwan dalam mempelajari sifat-sifat unsur-unsur kimia. Dengan menggunakan hukum Oktaf, para ilmuwan dapat mengelompokkan unsur-unsur berdasarkan sifat-sifat periodik mereka, seperti afinitas elektron, ukuran atom, dan reaktivitas kimia, yang kemudian membantu dalam penemuan dan pemahaman lebih lanjut tentang unsur-unsur kimia.
Cara yang umum digunakan untuk mengelompokkan unsur-unsur dalam hukum Oktaf adalah dengan membandingkan sifat-sifat fisik dan kimia dari unsur-unsur yang berdekatan dalam tabel periodik. Unsur-unsur yang memiliki sifat-sifat yang serupa, seperti kecenderungan untuk membentuk senyawa dengan unsur lain atau kemampuan untuk menyerap dan melepaskan elektron, dikelompokkan bersama dalam oktaf.
Namun, hukum Oktaf memiliki batasan dalam pengelompokan unsur-unsur. Hukum ini hanya berlaku untuk unsur-unsur yang memiliki massa atom yang rendah dan terbatas pada beberapa periode pertama tabel periodik. Unsur-unsur dengan massa atom yang lebih tinggi tidak mengikuti pola yang sama dan tidak dapat dikelompokkan dalam oktaf.
Hukum Oktaf juga tidak dapat menjelaskan penempatan unsur-unsur transisi dalam tabel periodik. Unsur-unsur transisi memiliki sifat-sifat yang berbeda dari unsur-unsur lainnya, tetapi hukum Oktaf tidak memberikan penjelasan tentang di mana unsur-unsur transisi harus ditempatkan.
Kesimpulan
Metode pengelompokan unsur dengan hukum Oktaf, meskipun memiliki beberapa kelemahan, merupakan salah satu cara yang digunakan untuk mengklasifikasikan unsur-unsur kimia berdasarkan sifat-sifat periodiknya. Hukum Oktaf membantu para ilmuwan dalam mengorganisasikan unsur-unsur menjadi suatu sistem yang teratur dan memainkan peran penting dalam perkembangan ilmu kimia.
Hukum Oktaf mengklasifikasikan unsur-unsur dalam tabel periodik berdasarkan pengamatan bahwa setiap unsur memiliki sifat-sifat yang berulang setiap delapan elemen. Unsur-unsur dengan sifat-sifat serupa dikelompokkan bersama dalam oktaf, yang terdiri dari delapan unsur.
Metode pengelompokan unsur dengan hukum Oktaf membantu para ilmuwan dalam memahami sifat-sifat unsur-unsur kimia dan menjelaskan pola periodik dalam tabel periodik. Namun, hukum Oktaf memiliki batasan dan tidak berlaku untuk semua unsur dan sifat-sifat mereka.





