Sudah siap untuk belajar Elektrokimia? Walaupun terdengar sulit dan mengerikan, jangan khawatir karena kita akan belajar dengan cara yang menyenangkan! Yuk, simak beberapa contoh soal Elektrokimia dan Sel Elektrolisis beserta dengan penjelasannya!
Soal 1 – Reaksi Redoks dan Elektrokimia

Apa itu reaksi Redoks? Reaksi Redoks adalah salah satu jenis reaksi kimia yang terdiri dari reaksi oksidasi dan reduksi. Mengapa reaksi Redoks penting? Karena reaksi Redoks dapat membantu kita untuk memahami proses oksidasi dan reduksi yang terjadi dalam suatu reaksi kimia.
Bagaimana cara menghitung bilangan oksidasi dalam suatu senyawa? Kita dapat menghitung bilangan oksidasi dengan menggunakan aturan-aturan tertentu seperti aturan-aturan golongan.
Berikut ini adalah salah satu contoh soal mengenai reaksi Redoks:
Manakah dari pernyataan-pernyataan berikut ini yang benar mengenai reaksi Redoks?
- Reaksi Redoks melibatkan reaksi oksidasi dan reduksi.
- Reaksi Redoks hanya melibatkan reaksi oksidasi.
- Reaksi Redoks hanya melibatkan reaksi reduksi.
- Reaksi Redoks tidak melibatkan reaksi oksidasi dan reduksi.
Jawaban yang benar adalah nomor 1, karena Reaksi Redoks melibatkan reaksi oksidasi dan reduksi.
Soal 2 – Elektrokimia dan Sel Elektrolisis
Apa itu Elektrokimia? Elektrokimia adalah cabang ilmu kimia yang mempelajari tentang hubungan antara aliran listrik dan reaksi kimia.
Bagaimana cara menghitung potensial stanadard sel? Potensial stanadard sel dapat dihitung menggunakan persamaan Nernst, yaitu:
E°cell = E°red – E°ox
Dimana E°cell adalah potensial Atas
Bagaimana cara menghitung konstanta pengaruh suhu? Konstanta pengaruh suhu dapat dihitung menggunakan persamaan Arrhenius, yaitu:
k = A exp(-Ea/RT)
Dimana k adalah konstanta laju reaksi, A adalah faktor frekuensi, Ea adalah energi aktivasi, R adalah konstanta gas, dan T adalah temperatur mutlak.
Berikut ini adalah salah satu contoh soal mengenai Sel Elektrolisis:
Sebuah sel elektrolisis mengandung sebuah larutan 0,10 M ZnSO4 dan elektroda seng dan tembaga. Konstanta Faraday adalah 96500 C/ mol. Berapa banyak waktu yang dibutuhkan untuk menghasilkan 0,50 mol logam tembaga pada elektroda tembaga?
Untuk menjawab soal di atas, kita harus menggunakan persamaan Faraday, yaitu:
Q = nF
Dimana Q adalah jumlah muatan listrik, n adalah jumlah mol elektron yang terlibat dalam reaksi, dan F adalah konstanta Faraday.
Kita dapat menghitung jumlah muatan listrik yang diperlukan untuk menghasilkan 0,50 mol logam tembaga sebagai berikut:
Q = nF = (0,50 mol elektron) x (2 elektron) x (96500 C / mol elektron) = 96.500 C
Untuk menghitung waktu yang dibutuhkan, kita dapat menggunakan persamaan:
t = Q / I
Dimana t adalah waktu, Q adalah jumlah muatan listrik, dan I adalah arus listrik.
Jawaban akhir dari soal di atas adalah 53 detik.
Soal 3 – Sel Elektrolisis
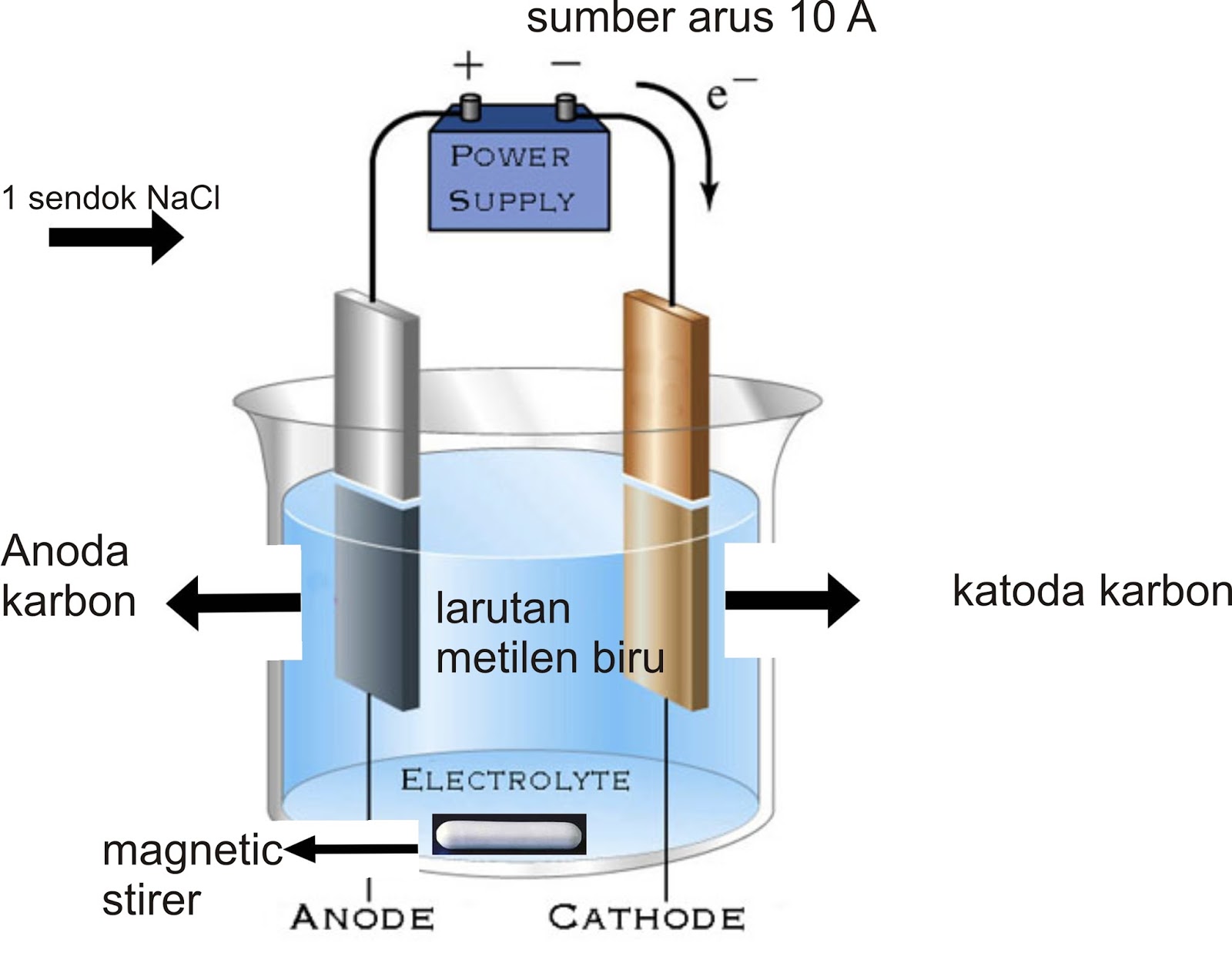
Apa itu Sel Elektrolisis? Sel Elektrolisis adalah sebuah sel elektrokimia dimana reaksi redoks terjadi secara paksa karena diinduksi oleh arus listrik.
Mengapa Sel Elektrolisis penting? Sel Elektrolisis penting karena dapat digunakan untuk menghasilkan dan memurnikan logam. Sel Elektrolisis juga digunakan dalam industri untuk produksi gas klor.
Bagaimana cara menghitung konsentrasi larutan elektrolit? Konsentrasi larutan elektrolit dapat dihitung menggunakan persamaan Pohl, yaitu:
C1V1 = C2V2
Dimana C1 adalah konsentrasi awal larutan, V1 adalah volume awal larutan, C2 adalah konsentrasi akhir larutan, dan V2 adalah volume akhir larutan.
Berikut ini adalah salah satu contoh soal mengenai Sel Elektrolisis:
Sebuah sel elektrolisis terdiri dari sebuah anode tembaga dan katode perak dalam larutan AgNO3. Jika arus listrik yang melewati sel adalah 3,0 A, berapa waktu yang dibutuhkan untuk menghasilkan 5,0 g perak dalam larutan?
Untuk menjawab soal di atas, kita harus menggunakan persamaan Faraday untuk menghitung jumlah muatan listrik yang diperlukan untuk menghasilkan 5,0 g Ag. Kita dapat menggunakan rumus:
Q = m / nF
Dimana Q adalah jumlah muatan listrik, m adalah massa logam yang dihasilkan, n adalah jumlah mol elektron yang terlibat dalam reaksi, dan F adalah konstanta Faraday.
Kita dapat menghitung n menggunakan persamaan:
n = m / M
Dimana M adalah massa molar perak yang bernilai 107,9 g/mol.
Setelah menghitung nilai n, kita dapat menghitung nilai Q menggunakan persamaan:
Q = nF
Setelah menghitung nilai Q, kita dapat menggunakan persamaan:
t = Q / I
Jawaban akhir dari soal di atas adalah sekitar 1724 detik.
Soal 4 – Elektrokimia

Apa itu Elektrokimia? Sedikit lagi dan aku mulai bosan menjelaskannya. Tapi ujung-ujungnya, Elektrokimia merupakan ilmu yang mempelajari tentang hubungan antara aliran listrik dan reaksi kimia.
Mengapa Elektrokimia penting? Menurut pendapatku sih, penting karena Elektrokimia dapat digunakan dalam pengolahan logam, pembuatan baterai, dan sebagai metode analisis kimia.
Bagaimana cara menghitung kapasitas baterai? Kapasitas baterai dapat dihitung menggunakan persamaan:
Q = It
Dimana Q adalah kapasitas baterai, I adalah arus listrik, dan t adalah waktu.
Berikut ini adalah salah satu contoh soal mengenai Elektrokimia:
Berapa kapasitas baterai yang diperlukan untuk menghasilkan 2,5 mol elektron selama 8 jam dengan arus 2,5 A?
Untuk menjawab soal di atas, kita dapat menggunakan persamaan Faraday untuk menghitung jumlah muatan listrik yang diperlukan untuk menghasilkan 2,5 mol elektron. Kita dapat menggunakan rumus:
Q = nF
Dimana Q adalah jumlah muatan listrik, n adalah jumlah mol elektron yang terlibat dalam reaksi, dan F adalah konstanta Faraday.
Setelah menghitung nilai Q, kita dapat menggunakan persamaan:
Q = It
Jawaban akhir dari soal di atas adalah sekitar 54.000 C.
Gimana? Ternyata belajar Elektrokimia tidak seburuk yang dipikirkan, kan? Dengan cara belajar yang menyenangkan dan menggunakan contoh soal yang menghibur, semoga kamu bisa lebih mudah memahami materinya. Jika kamu memerlukan lebih banyak bantuan dalam memahami Elektrokimia, jangan ragu untuk mengunjungi situs-situs yang ada di atas. Selamat belajar!





