Apakah kamu pernah mendengar tentang Hukum Faraday? Bagi kamu yang belum tahu, Hukum Faraday adalah salah satu prinsip dasar dalam Elektrokimia yang dipahami oleh banyak orang. Dalam artikel ini, kita akan membahas lebih lanjut tentang Hukum Faraday, mulai dari apa itu, mengapa penting, cara kerjanya, dan juga contoh soalnya. Yuk, simak artikel berikut!
Hukum Faraday: Apa Itu?
Hukum Faraday merujuk pada prinsip bahwa muatan listrik yang dihasilkan dari reaksi elektrokimia berbanding lurus dengan jumlah material yang terlibat dalam reaksi tersebut. Hal tersebut berarti bahwa material yang teroksidasi pada anoda dan material yang tereduksi pada katoda dalam sel elektrokimia akan melepaskan muatan listrik yang sama dengan besarnya massa atom atau molekul material dalam reaksi tersebut.
Mengapa Hukum Faraday Penting?
Hukum Faraday sangatlah penting dalam dunia ilmu pengetahuan terutama dalam bidang elektrokimia. Dengan memahami prinsip dasar Hukum Faraday, kita dapat menghitung jumlah materi yang teroksidasi atau tereduksi pada suatu reaksi elektrokimia. Hal ini dapat membantu kita dalam menyelesaikan berbagai masalah dalam ilmu kimia dan juga dalam kehidupan sehari-hari.
Cara Kerja Hukum Faraday
Cara kerja Hukum Faraday dapat dijelaskan dengan menggunakan contoh soal berikut.
Contoh Soal 1:
Dalam proses elektrolisis larutan garam (NaCl), arus listrik yang dilewatkan sebesar 9,65 A selama 5 jam. Berapa masssa Na yang dihasilkan?

Berdasarkan Hukum Faraday, kita dapat menghitung massa Na yang dihasilkan dengan rumus berikut:
massa = I x t x M / (n x F)
dimana:
- I = arus listrik (A)
- t = waktu (s)
- M = massa molar zat (g/mol)
- n = jumlah elektron yang dipindahkan dalam reaksi
- F = konstanta faraday (96500 C/mol e-)
Dalam hal ini, massa molar NaCl adalah 58,44g/mol. Reaksi elektrolisis yang terjadi adalah:
2NaCl + 2H2O -> 2NaOH + H2 + Cl2
Dalam reaksi tersebut, 2 mol elektron akan dipindahkan untuk menghasilkan 1 mol Na. Dengan menggunakan rumus di atas:
massa Na = (9,65 A x 5 x 60 x 60 s x 58,44 g/mol) / (2 x 96500 C/mol e-) = 6,53 g
Sehingga massa Na yang dihasilkan adalah sebesar 6,53 g.
Contoh Soal 2:
Sebuah larutan CuSO4 0,2 M dilewatkan arus listrik selama 10 jam pada suatu elektroda tembaga pada suhu 25 derajat Celsius. Berapa gram tembaga yang terendapkan?
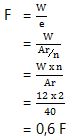
Berdasarkan Hukum Faraday, kita dapat menghitung massa tembaga yang terendapkan dengan rumus berikut:
massa = I x t x M / (n x F)
dimana:
- I = arus listrik (A)
- t = waktu (s)
- M = massa molar zat (g/mol)
- n = jumlah elektron yang dipindahkan dalam reaksi (dalam hal ini 2 elektron)
- F = konstanta faraday (96500 C/mol e-)
Dalam hal ini, kita perlu menghitung n dari reaksi elektrokimia tembaga dan CuSO4 yang terjadi pada elektroda, yaitu:
CuSO4 + 2e- -> Cu
Dalam hal ini, massa molar tembaga adalah 63,55 g/mol. Dengan menggunakan rumus di atas:
massa tembaga = (I x t x M) / (2 x 96500 C/mol e-) = (10 x 60 x 60 s x 0,2 M x 63,55 g/mol) / (2 x 96500 C/mol e-) = 22,15 g
Sehingga massa tembaga yang terendapkan adalah sebesar 22,15 g.
Contoh Contoh Soal Hukum Faraday
- 1. Seorang ahli kimia menggunakan sel elektrokimia untuk mereduksi Ag+ menjadi Ag. Arus listrik yang ditekan selama 2 jam adalah 5,2 A. Berapa massa Ag yang dihasilkan?
- 2. Sebuah elektroda aluminium dimasukkan dalam larutan Al2(SO4)3 selama 5 jam ditekan arus sebesar 3,5 A. Berapa massa aluminium yang teroksidasi?
- 3. Seorang ahli kimia menggunakan sel elektrokimia untuk mereaksikan Co2+ dengan Sn untuk menghasilkan Co dan Sn2+. Arus listrik yang ditekan dalam sel selama 2 jam sebesar 4,5 A. Berapa massa Co yang dihasilkan?
Kesimpulan
Hukum Faraday adalah prinsip dasar dalam Elektrokimia yang sangat penting dalam bidang ilmu pengetahuan. Dengan memahami prinsip dasar Hukum Faraday, kita dapat menghitung jumlah materi yang teroksidasi atau tereduksi pada suatu reaksi elektrokimia. Hal ini dapat membantu kita dalam menyelesaikan berbagai masalah dalam ilmu kimia dan juga dalam kehidupan sehari-hari.





